- Ботулинотерапия для лечения гиперпотливости ладоней
- Лечение гипергидроза рук ладоней
- Симптомы гипергидроза ладоней
- Степени гипергидроза ладоней
- Причины повышенного потоотделения ладоней
- Лечение гипергидроза ладоней
- Как проходит процедура
- После введения ботулотоксина
- Противопоказания
- Омоложение рук
- Способы омоложения кожи рук
- Биоревитализация
- Мезотерапия
- Лазерный фракционный термолиз
- Плазмолифтинг
- Пилинг
- Контурная пластика рук
- Мезонити
- К вопросу о ботулинотерапии постинсультного спастического пареза: механизмы действия ботулотоксина, алгоритм восстановительного лечения
Ботулинотерапия для лечения гиперпотливости ладоней
В нашей клинике проблему потливости ладоней (гипергидроза) можно решить при помощи инъекций ботулотоксина.
Что такое гипергидроз?
Различают общий и локализованный тип заболевания.
- Первый проявляется при переживаниях, высокой температуре, физической активности и при ряде заболеваний.
- Второй возникает при гормональных нарушениях, вегетососудистой дистонии, несоблюдении личной гигиены, при плоскостопии, ношении синтетической одежды и тесной обуви.
Основными симптомами гипергидроза являются: неприятный запах, обильное потоотделение, неприятные ощущения.
Роль ботулинотерапии в лечении гипергидроза
Ботулотоксин, который используется во время процедуры, блокирует передачу ацетилхолина, который влияет на нервный импульс. В результате он не передается по нервному волокну, и работа сальных желез останавливается. Потовые железы находятся в дисфункциональном состоянии примерно полгода, после действие ботулотоксина ослабляется, ацетилхолин начинает нормально высвобождаться в пресинаптическую щель, нервный импульс проходит по нервному волокну, работа желез восстанавливается. Инъекции ботулотоксина не вызывают привыкания, поэтому процедуру можно повторить для возобновления эффекта.
Проведение процедуры: особенности, подготовка, техника
Перед проведением инъекций Ботокса необходимо пройти обследование у специалиста. Врач назначит специальные тесты и анализы. По результатам ставится точный диагноз и планируется курс лечения. В индивидуальном порядке рассчитывается доза и места введений. В среднем продолжительность процедур составляет две недели, а количество сеансов ограничивается 10 инъекциями.
Для инъекций ботулотоксина не требуется дополнительная подготовка. Непосредственно перед уколом врач обработает поверхность ладоней антисептическими и анестизирующими препаратами. Инъекции выполняются по всей поверхности тыльной стороны кисти. Точечные уколы ставятся через каждый сантиметр. Результат станет заметен через 3–7 дней.
Лечение гипергидроза рук ладоней
На данную услугу действует акция
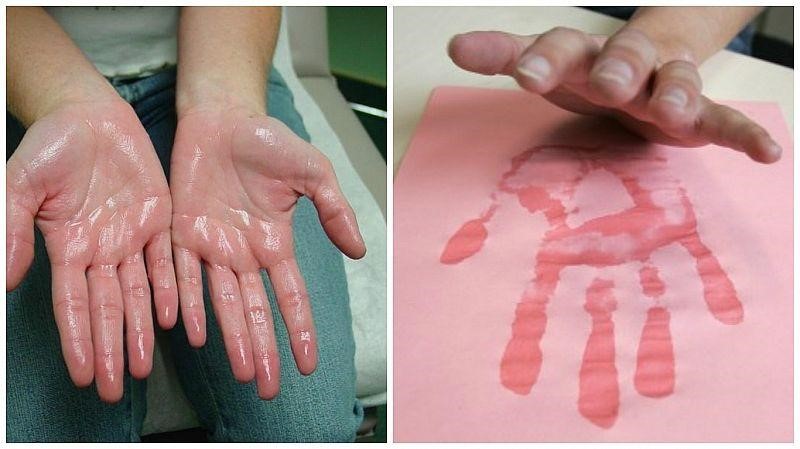
Гипергидроз ладоней, или по-научному «пальмарный гипергидроз» – повышенное потоотделение кожи в области ладоней. С проблемой «мокрых» ладоней сталкиваются около 3% людей.
Когда температура воздуха повышается, когда человек волнуется или находится под воздействием стресса или болезни, то потоотделение естественным образом усиливается, но, когда потливость ладоней беспокоит непрерывно и не зависит от провоцирующих факторов, это приносит психологические страдания и нарушает процесс общения с другими людьми.
Симптомы гипергидроза ладоней
Гипергидроз ладоней проявляется весьма характерными признаками:
- при прикосновении к бумаге, ткани и другим материалам на них остается влажный след от ладоней;
- кожа ладоней периодически краснеет;
- ладони постоянно мокрые, либо на них часто выступают капли пота.
Степени гипергидроза ладоней
Выделяют несколько стадий этой патологии в зависимости от тяжести проявлений:
- Легкое течение. Ладони постоянно влажные.
- Умеренное. Влажные не только ладони, но и пальцы рук.
- Тяжелая форма. Пот обильно стекает по ладоням.
Причины повышенного потоотделения ладоней
Самая распространенная форма гипергидроза – идиопатическая. Она развивается без причин с младенчества и усиливается в подростковом возрасте. Эта форма не опасна для здоровья, но может стать причиной серьезных психологических проблем.
Кроме того, выделяют множество причин, которые приводят к повышенному потоотделению ладоней:
- чрезмерная активность симпатической нервной системы (она отвечает за выделение пота);
- вегетососудистая дистония;
- нарушения работы гормональной системы или период «перестройки организма» (подростковый возраст, беременность, климакс);
- генетическая предрасположенность;
- психологические проблемы (например, частые стрессы).
Лечение гипергидроза ладоней
На сегодняшний день существуют разнообразные способы коррекции и лечения проблемы повышенного потоотделения:
- использование специальных антиперспирантов с солями алюминия в составе;
- физиотерапевтические методы, например, электрофорез;
- прием лекарственных препаратов;
- инъекционное введение препаратов ослабленного ботулотоксина («Ботокс» и «Диспорт»)в качестве потоблокирующих агентов;
- хирургическое вмешательство. Применяется крайне редко, когда вышеперечисленные способы нерезультативны.
Одним из самых эффективных, современных и наиболее безопасных способов избавления от гипергидроза является инъекционное введение препаратов «Ботокс» (США) и «Диспорт» (Франция). Процедура заключается во введении ослабленного токсина ботулина (который входит в состав препаратов) в зону ладоней. При введении в проблемную зону блокируется выделение ацетилхолина, что приводит к долговременному купированию функций потовых желез.
Процедура непродолжительна по времени, не имеет последствий для здоровья и не требует реабилитации (нет следов на коже после лечения), а эффект развивается в максимально короткие сроки (уже через одну-две недели)
Как проходит процедура
Процедура выполняется очень быстро, поэтапно, дает отличный устойчивый результат и не имеет побочных эффектов.
На первом этапе, чтобы оценить площадь введения ботулотоксина, специалист нашей клиники проводит пробу Минора. Для этого на кожу ладоней наносят йодный раствор, а затем посыпают крахмалом. Когда начинают работать потовые железы и выделяется пот, начинается взаимодействие между йодом и крахмалом, и проступает черное пятно, которое очерчивает зону для введения препарата.
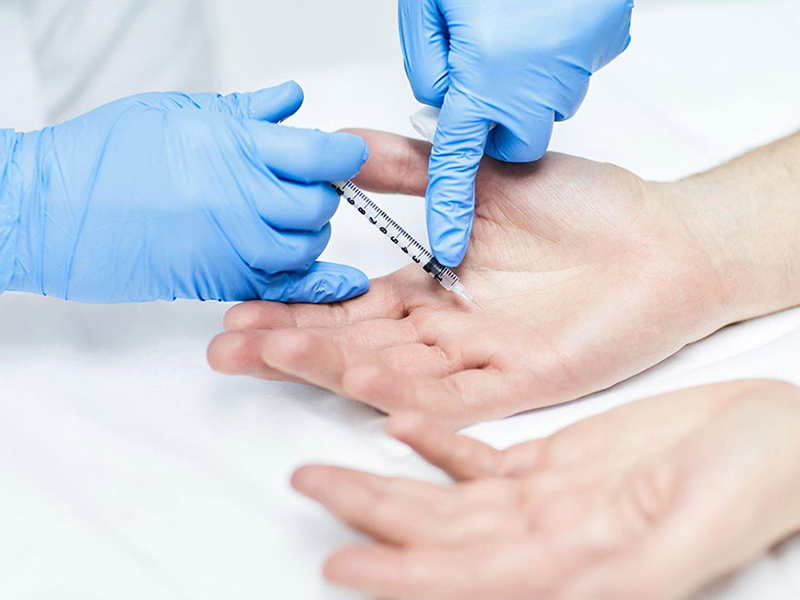
На втором этапе проводится обезболивание и введение препарата:
- дезинфекция. Ладони протираются антисептическим раствором;
- обезболивание. На руки наносится крем-анестетик или кисти сильно охлаждаются;
- нанесение разметки на кожу;
- последовательное введение препарата Ботокс или Диспорт с помощью инсулинового шприца на каждые один-два квадратных сантиметра.
Количество единиц — дозировка препарата определяется индивидуально в зависимости от степени выраженности гипергидроза. Результат заметен через семь дней, но наибольший эффект достигается через две недели и длится от 6 до 18 месяцев.
После введения ботулотоксина
После процедуры нужно соблюдать следующие рекомендации в течение 7 дней:
- не употреблять алкоголь;
- отказаться от дезодорантов и антиперспирантов; горячих ванн, бани, сауны;
- не заниматься слишком активно спортом и тяжелой физической работой;
- не находиться на солнце, чтобы не инактивировать введённый препарат.
В дальнейшем рекомендуется чаще использовать увлажняющий крем после каждого мытья рук. Стоит отдавать предпочтение мылу без спирта в составе.
Для того, чтобы избавиться от гипергидроза ладоней на длительное время нужна всего одна процедура.
В дальнейшем, после окончания срока действия ботулотоксина на потовые железы, процедуру можно повторить вновь. Метод абсолютно безопасен: ботулотоксин не проникает в общий кровоток, а действует только на уровне кожи.
Противопоказания
Как и у любой процедуры, для ботулинотерапии есть свои ограничения. Абсолютными противопоказаниями к лечению Диспортом и Ботоксом являются:
- Острые инфекционные болезни.
- Воспалительный процесс в месте введения препарата.
- болезни крови (гемофилия) и проблемы в работе нервно-мышечной системы.
- Беременность, лактация.
- Невосприимчивость препаратов с ботулотоксином.
Относительные противопоказания для введения ботулотоксина — хронические заболевания в стадии обострения, склонность к образованию рубцов келоидного типа, гипертермия.
Если вы решили избавиться от постоянно мокрых ладоней, то в нашей клинике вам гарантировано грамотное проведение процедуры лечения гипергидроза сертифицированными специалистами. Мы вводим только сертифицированные препараты по ценам ниже, чем у конкурентов.
Омоложение рук
По своей природе кожа рук является достаточно тонкой и часто сухой. В ней сосредоточено слишком мало сальных желез, которые могли бы обеспечить защитный слой. При этом руки постоянно подвергаются агрессивным воздействиям природных факторов, бытовой химии и прочим, а значит, быстрее стареют. Именно поэтому необходимы систематические мероприятия по питанию и увлажнению кожи на руках, а зачастую — специальные косметологические процедуры.

- сухость;
- дряблость кожи;
- морщины;
- пигментация;
- восстановление утраченного объема тканей.
Способы омоложения кожи рук
Избавиться от признаков старения, вернуть эластичность кожи и привлекательный вид рук помогают разные косметологические процедуры:
- биоревитализация;
- мезотерапия;
- лазерное омоложение (фракционный термолиз);
- плазмолифтинг;
- пилинг;
- контурная пластика рук;
- мезонити.
Биоревитализация
Избавиться от сухости можно с помощью биоревитализации. Данная процедура основана на инъекционном введении в кожу препаратов на основе высокомолекулярной гиалуроновой кислоты и позволяет:
- повысить увлажненность и эластичность тканей;
- уменьшить стянутость кожи рук;
- вернуть молодость кожи;
- восстановить ее объем;
Биоревитализация гиалуроновой кислотой в кратчайшие сроки восполнит водный баланс и вернет упругость и эластичность кожи рук.
Данная процедура проводится курсом, состоящим из 4-6 процедур, с периодичностью один раз в 10-14 дней. В зависимости от степени выраженности проблемы курс необходимо повторять 1 или 2 раза в год
Мезотерапия
Омоложение кистей рук также возможно с помощью мезотерапии. Поливитаминные коктейли вводятся инъекционно один раз в неделю, курсом по 8-10 процедур порядка двух раз в год. Такая методика позволяет:
- увлажнить кожу;
- улучшить кровообращение;
- повысить гладкость и эластичность.
Стоит заметить, что данная методика превосходит по количеству процедур биоревитализацию, однако уступает ей по эффективности.
Мезотерапии отдается предпочтение при незначительной выраженности клинических симптомов.
Лазерный фракционный термолиз
Благодаря фракционному омоложению кистей рук удается:
- избавиться от дряблости и морщин;
- устранить желтоватый оттенок;
- избавиться от пигментации и рубцов;
- повысить упругость;
- выровнять рельеф.
Процедура проводится курсом по 3–4 сеанса с перерывом между ними в 3-5 недель. Лазерное воздействие позволяет восстановить коллагеновый каркас и вернуть упругость тканям.
При выраженной сухости кожи рук рекомендуется сочетание с биоревитализацией, при этом количество обеих процедур уменьшается вдвое, а эффективность возрастает.
Плазмолифтинг
Инъекции плазмолифтинга — высокоэффективный способ омоложения кистей рук. Плазменный концентрат с большим количеством тромбоцитов вводится под кожу, начиная от пальцев и заканчивая запястьем. Процедура обеспечивает стимуляцию выработки коллагена и эластина. Результатами плазмолифтинга являются:
- улучшение цвета кожи за счет усиления микроциркуляции
- разглаживание мелких морщин;
- устранение дряблости.
Пилинг
С целью омоложения кожи рук возможно применение как поверхностного, так и срединного пилинга. Выбор основан на выраженности клинической картины.
Цель пилинга рук:
- улучшить проникновение средств наносимых после процедуры;
- усилить регенерацию тканей
- уменьшить неравномерность расположения пигмента.
Процедуры проводятся курсом от 2-х до 4-х процедур с периодичностью в 2-4 недели. Возможно сочетание с такими процедурами как мезотерапия, биоревитализация, плазмотерапия.
- повышение упругости кожи рук
- уменьшение дряблости
- уменьшение пигментации
- улучшение цвета кожи
Контурная пластика рук
Контурная пластика позволяет восполнить утраченный объем тканей кисти за счет введения филлеров на основе гиалуроновой кислоты. Данная процедура показана при:
- снижении подкожного жира кистей;
- наличии очень тонкой и дряблой кожи;
- выраженном проявлении сосудов;
- заметном контурировании сухожилий кистей.
Контурная пластика проводится однократно, чаще всего используются препараты средней плотности, объемом 1 или 2 мл в зависимости от выраженности потери объема. Эффект в среднем длится около года, далее возможно повторение процедуры.
Мезонити
Омоложение кистей рук введением мезонитей – одно из современных направлений, однако довольно «молодое».
Основная цель – создать микрофиброз на введенные мезонити (аналог шовного материала), который впоследствии обеспечит упругость тканей, уменьшит дряблость.
Основной минус – это вероятное возникновение гематом и чувствительность процедуры. Однако использование анестезии позволяет улучшить переносимость, а специализированные крема ускорить рассасывание гематом.
Эффект после процедуры проявляется через 2-4 недели, постепенно нарастая и длится около года.
К вопросу о ботулинотерапии постинсультного спастического пареза: механизмы действия ботулотоксина, алгоритм восстановительного лечения
Рассмотрены возможности лечения постинсультной спастичности препаратами ботулинического нейротоксина. Лечение хорошо переносится, не связано с риском серьезных осложнений, возможен выбор одной или нескольких мышц для инъекции и подбор дозы препарата, обес
Possibilities of treatment of postapoplectic spasticity with preparations of botulinic neurotoxin have been analyzed. Treatment is easily sustained, it does not cause serious complications. It is possible to choose one or several muscles for injection and selection of doze that gives required degree of relaxation.
В нашей стране ежегодно регистрируется около 400 тыс. инсультов, при этом примерно у одной трети больных, выживших после инсульта, развивается спастичность [1]. По данным ВОЗ, распространенность постинсультной спастичности в мире составляет 200 человек на 100 тыс. жителей, спастичностью страдает более 12 млн больных [2].
Спастический мышечный гипертонус характеризуется возникновением увеличивающегося сопротивления при первых быстрых пассивных движениях и затем внезапном уменьшении его — феномен «складного ножа» по Шеррингтону. В настоящее время под спастичностью понимают двигательное нарушение, являющееся частью синдрома поражения верхнего мотонейрона, характеризующееся скорость-зависимым повышением мышечного тонуса и сопровождающееся повышением сухожильных рефлексов в результате гипервозбудимости рецепторов растяжения [3, 4].
Однажды развившись, спастический парез, как правило, сохраняется в течение всей жизни больного. При этом если спастичность сохраняется в течение длительного времени, развиваются вторичные изменения в мышцах, сухожилиях и суставах (фиброз, атрофия, контрактура). Лечение спастического пареза — пока практически неразрешимая задача. В связи с этим столь актуальной является разработка подходов к лечебному воздействию на мышечную спастичность, основанных на изучении механизмов ее развития [5].
Для коррекции мышечного гипертонуса нередко используют различные методы физиотерапии, лечебной физкультуры, рефлексотерапии, а также фармакологическое лечение в виде назначения миорелаксантов [6].
В последние годы при лечении постинсультной спастичности стали применяться препараты ботулинического нейротоксина типа А. Данный метод лечения предложен для освоения практикующим врачам сравнительно недавно, несмотря на то, что первое научное сообщение о применении блокад ботулотоксина появилось в печати более 20 лет назад [7].
В сравнении с имеющимися методами лечения мышечного гипертонуса, локальное введение ботулотоксина имеет ряд несомненных преимуществ [8]. Во-первых, лечение хорошо переносится и не связано с риском серьезных осложнений. Во-вторых, возможен выбор одной или нескольких мышц для инъекции и подбор дозы препарата, обеспечивающей желаемую степень расслабления.
Как известно, ботулизм — тяжелое инфекционное заболевание, проявляющееся периферическими параличами мышц и вегетативными расстройствами вследствие нарушения периферической холинергической медиации, вызываемого ботулиническим нейротоксином. В настоящее время известны 8 серологических подтипов ботулотоксина: А, В, С1, С2, D, E, F, G. Ботулизм у человека могут вызвать серотипы А, В, Е, F, G, но самым сильнодействующим является тип А [9].
Как в своей природной форме, так и в виде лекарства ботулотоксин представляет смесь различных белков. Основные составные их части — нейротоксин и нетоксичные протеины. Нейротоксин состоит из двух полипептидных цепей (легкой — массой 50 кДа и тяжелой — массой 100 кДа), соединенных одной дисульфидной группой и одним атомом цинка. Такая структура молекулы нейротоксина обуславливает лабильность ее конформации и неустойчивость к действию механических, физических и химических факторов, приводящих к потере биологической активности. В своей лекарственной форме нейротоксиновые цепи окружены и стабилизированы крупными пептидными молекулами гемагглютининов и нетоксичных негемагглютининовых протеинов. Большая молекулярная масса нетоксичной части комплекса (730 кДа) препятствует как расщеплению нейротоксина, так и быстрой диффузии его в окружающие ткани, обеспечивая тем самым локальность воздействия. Однако присутствие белковых молекул является фактором, способствующим образованию нейтрализующих антител ко всему нейротоксин-гемагглютининовому комплексу, что может явиться причиной вторичной нечувствительности пациентов к повторным инъекциям препарата [10].
Аминокислотный состав нейротоксина типа А расшифрован, в легкой цепи содержится 448 аминокислот, в тяжелой — 848. Другие серотипы ботулотоксина отличаются количеством и последовательностью аминокислот, главным образом, в легкой цепи [11].
Принципиальный механизм действия всех типов ботулинических токсинов заключается в пресинаптической блокаде выброса ацетилхолина из нервной терминали периферического холинергического синапса. Ацетилхолин является медиатором в синапсах парасимпатической нервной системы, некоторых синапсах ЦНС, в соматических двигательных и преганглионарных симпатических нервных окончаниях. Холинорецепторы находятся в скелетных и гладких мышцах, внутренних органах, симпатических и парасимпатических ганглиях. Выделяют М- и Н-холинорецепторы. Особым видом холинорецепторов является Н-холинорецепторы афферентных окончаний, расположенных в вегетативных ганглиях, где они по существу являются рецепторами сенсорного волокна [12].
Передача нервного импульса в холинергическом синапсе происходит в несколько этапов. В пресинаптической нервной терминали постоянно синтезируется и накапливается ацетилхолин в виде везикул, которые транспортируются к пресинаптической мембране, с тем, чтобы молекула медиатора могла выйти в синаптическую щель и связаться со специфическими холинергическими рецепторами постсинаптической мембраны. На этом участке постсинаптической мембраны возникает мембранный потенциал и происходит сокращение мышечного волокна. Однако процесс транспорта везикул ацетилхолина к пресинаптической мембране происходит не спонтанно, а активно с помощью комплекса особых транспортных белков, главными из которых являются SNAP-25, синтаксин и синаптобревин. Именно транспортные белки являются мишенью действия ботулинических нейротоксинов. При попадании ботулотоксина в мышцу или другой орган-мишень (с током крови при ботулизме или с лечебной целью при инъекции) молекулы токсинового комплекса достигают нервных терминалей аксонов, прикрепляются к ним, и далее нейротоксиновая часть внедряется в цитозоль нервной терминали, где распадается на короткую и длинную цепи. Короткая цепь (являющаяся цинк-зависимой протеазой) необратимо и специфично расщепляет транспортный белок, тем самым делая невозможным выход ацетилхолина в синаптическую щель и мышечное сокращение [13, 14].
При внутримышечном введении ботулотоксина развиваются два эффекта: прямое ингибирование альфа-мотонейронов на уровне нервно-мышечного синапса и ингибирование гамма-мотонейронного холинергического синапса на интрафузальном волокне. Снижение гамма-активности ведет к расслаблению интрафузальных волокон мышечного веретена и уменьшает активность 1а-афферентов. Это приводит к снижению активности как мышечных рецепторов растяжения, так и эфферентной активности альфа- и гамма-мотонейронов. Клинически это проявляется в выраженном расслаблении инъецированных мышц и значительном уменьшении боли в них [15].
При локальном введении в терапевтических дозах, ботулотоксин не проникает через гематоэнцефалический барьер и не вызывает существенных системных эффектов [16].
Серотипы ботулотоксина различаются по своему сродству к транспортным белкам. Подтипы А и Е блокируют SNAP-25, подтипы В, D, F, G — синаптобревин, а подтип С блокирует синтаксин и SNAP-25. Процесс пресинаптического расщепления транспортных белков ботулотоксином является необратимым и занимает в среднем 30–60 минут, поэтому специфический ботулинический антитоксин эффективен лишь в течение получаса после поступления токсина к органам-мишеням. Несмотря на то, что клеточные эффекты развиваются очень быстро и необратимо, клиническое миорелаксирующее действие препарата после проведенной инъекции начинается проявляться через несколько дней. Однако имеются наблюдения как мгновенного наступления эффекта, так и отсроченного на 3–4 недели [17].
Через 1–2 месяца после инъекции начинается процесс отрастания новых нервных терминалей от аксонов, где прежде был блокирован транспорт ацетилхолина, с образованием новых функционально активных нервно-мышечных синапсов (спраутинг), что приводит в конечном итоге к восстановлению мышечных сокращений через 3–6 месяцев после инъекции, но иногда длительность эффекта сохраняется до 1 года и более [18].
Гистологическими исследованиями доказано, что даже после 30 повторных инъекций в одну и ту же мышцу не возникает необратимой деиннервации и атрофий [19, 20].
Исключительно важной является разработка способов усиления и продления эффекта инъекции, поскольку частые повторные инъекции могут приводить к образованию антител, а также существенно удорожают стоимость лечения. Выявлено, что более стойкие и полные эффекты токсина проявляются при максимальном мышечном сокращении, при достаточной внутриклеточной концентрации ионов кальция (возможно и калия), при воздействии низких температур. Поэтому во время подготовки к лечебной инъекции за 2 недели пациенту рекомендуется назначить прием препаратов кальция и калия с витамином D, непосредственно перед инъекцией и сразу после нее — охлаждать область инъекции, а также интенсивно напрягать инъецируемые мышцы в течение 15–30 минут после процедуры [21, 22].
Размер поля деиннервации, вызываемой инъекцией токсина, зависит от дозы токсина и объема вводимого раствора. Наилучшие результаты достигаются при равномерном распределении препарата в несколько точек вдоль одной мышцы. Кроме того, более полная блокада нервных терминалей наступает при инъекции токсина вблизи концевых моторных пластинок периферического нерва [23].
В настоящее время накопились факты, свидетельствующие о том, что эффекты ботулотоксина значительно сложнее и шире, чем временный локальный блок проведения в терминалях альфа-мотонейронов. По-видимому, имеется блокада как интрафузальных, так и экстрафузальных волокон, что может объяснить более широкую зону действия токсина и на терминали чувствительных волокон различной модальности. В частности, это может объяснить быстрый анальгетический эффект инъекции ботулотоксина. За счет механизма деафферентации рецепторов мышечных веретен и других видов чувствительных систем ботулотоксин может оказывать непрямые эффекты на вышележащие отделы центральной нервной системы. При исследовании моторного потенциала выявлено уменьшение латентных периодов его компонентов, снижение активации париетальной коры и каудальной дополнительной моторной области при позитронно-эмиссионной томографии, изменение реципрокного торможения на уровне спинного мозга у больных с постинсультными спастическими парезами [24, 25].
В настоящее время в России разрешены к использованию следующие препараты ботулинического нейротоксина типа А: Ботокс (США), Диспорт (Великобритания), Ксеомин (Германия), Лантокс (Китай). Содержание токсинов в этих препаратах различно: Ботокс, Ксеомин и Лантокс содержит в 1 единице 0,4 нг нейротоксина, Диспорт — 0,025 нг (одна единица соответствует LD50 (средняя летальная доза ботулотоксина) для самок мышей Swiss-Webster весом 18–20 г). Токсичность (LD50) для обезьян составляет при внутримышечном введении 39 ЕД/кг, при внутривенном введении — 40 ЕД/кг [26].
Следует избегать назначения более чем 300–400 ЕД в течение одной сессии инъекции. К настоящему времени не выявлено серьезных побочных действий препаратов ботулотоксина при применении его в рекомендуемых дозах. Возможно возникновение чрезмерной мышечной слабости, однако со временем происходит восстановление мышечной силы. Может наблюдаться также вторичная резистентность к препарату, для профилактики которой рекомендуют делать интервал между сессиями инъекций не менее 12 недель. Не выявлено также эффекта взаимодействия ботулотоксина и пероральных миорелаксантов центрального действия [27, 28].
На сегодняшний день широкое применение ботулинотерапии при постинсультной спастичности в значительной степени ограничивается высокой стоимостью препарата. Однако проведенное в Германии исследование по изучению эффективности трех вариантов лечения постинсультной спастичности: физиотерапия, ботулинотерапия + физиотерапия, баклофен + физиотерапия — показало, что снижение спастичности при сочетании ботулотоксина и физиотерапии было в три раза значительнее, чем при использовании баклофена и физиотерапии, и в десять раз больше, чем при применении одной физиотерапии. Оценка показателя стоимость/эффективность лечения постинсультной спастичности была ниже при использовании ботулотоксина и физиотерапии, чем при других методах лечения [29, 30].
Для более обоснованного назначения препарата O’Brien С. [31] рекомендует придерживаться следующего алгоритма назначения препаратов ботулотоксина при постинсультной спастичности (рис.).
В данном алгоритме С. O’Brien не рекомендует проведение ботулинотерапии при фиксированных контрактурах в суставах. В ситуации фиксированной контрактуры, вызванной укорочением сухожилий или дистрофическими изменениями в самом суставе, введение ботулотоксина приводит к расслаблению спастических мышц, но объем движения в суставе не увеличивается и двигательные функции остаются прежними. Однако, по мнению Е. Д. Белоусовой [32], ввиду наличия функционально невыгодной контрактуры (кисти, эквиноварусной деформации стопы), не обеспечивающей работоспособность конечности, выраженного болевого синдрома, введение ботулинического токсина в спастичные мышцы является обоснованным.
В настоящее время расчет дозы препарата ботулотоксина типа А, а также точки его введения в мышцы-мишени при различных проявлениях постинсультной спастичности определяют по рекомендациям Brin M. F. and Spasticity Study Group (табл.) [33].
По данным рекомендациям, минимальные дозы нейротоксина вводят при легкой степени спастичности, максимальные дозы — при выраженной степени спастичности и больших размерах мышц. Общая доза препарата не должна превышать 400 ЕД.
У всех пациентов с постинсультными спастическими двигательными расстройствами, в связи с повышением тонуса сгибателей запястья и пальцев рекомендуется обязательное введение ботулотоксина в следующие мышцы: лучевой сгибатель запястья по 20–40 ЕД, локтевой сгибатель запястья по 20–40 ЕД, поверхностный сгибатель пальцев по 20–40 ЕД, глубокий сгибатель пальцев по 30–60 ЕД. Общая доза препарата составляет 75–150 ЕД. Инъекции всех этих мышц (в 1–2 точки) осуществляются при введении инъекционной иглы в поперечном по отношению к предплечью направлению с поэтапным введением препарата в каждую мышцу. В остальные мышцы-мишени верхней конечности введение ботулотоксина зависит от клинического паттерна.
В нижней конечности, в связи с повышением мышечного тонуса в задней группе мышц голени, выясняется, какая из мышц задней группы голени (икроножная или камбаловидная) играет ведущую роль в спастичности. Если высокий тонус в голеностопном суставе (при тыльном сгибании стопы) определяется при разогнутом коленном суставе, но существенно ослабевает при сгибании, то это указывает на ведущую роль икроножной мышцы в спастичности, поскольку при сгибании колена происходит расслабление икроножной мышцы, участвующей как в сгибании колена, так и в подошвенном сгибании голеностопного сустава. В этих случаях вводят 100–150 ЕД ботулотоксина в четыре точки икроножной мышцы (по 25–35 ЕД в каждую точку). В тех случаях, когда спастичность в равной мере вызвана как икроножной, так и камбаловидной, дополнительно, в дозе 50–100 ЕД в две точки (по 25–50 ЕД), препарат вводят в камбаловидную мышцу. Выбор остальных мышц-мишеней ноги также зависит от клинического паттерна [34].
Максимальный эффект после проведения ботулинотерапии отмечается, в среднем, через 2–3 недели после проведения инъекций. Повторное нарастание мышечной спастичности происходит, как правило, через 4–6 месяцев после введения ботулотоксина, что требует повторения процедуры [35].
В заключение необходимо отметить, что во всех случаях после проведения ботулинотерапии требуется активная физиотерапия и физическая реабилитация. Ботулинотерапия не заменяет физиотерапию и лечебную физкультуру, что составляет основу реабилитационной программы у больных, перенесших мозговой инсульт, а представляет лишь интегральную часть комплексного восстановительного лечения, направленного на улучшения двигательных функций.
Значительное число вопросов, связанных с применением ботулинического токсина при спастичности, требуют дальнейшего изучения [36–39]. Во-первых, безопасно и эффективно ли использование больших доз ботулотоксина, что часто необходимо при выраженной спастичности во многих мышцах у больных после мозгового инсульта? Во-вторых, в какие сроки с момента инсульта следует проводить ботулинотерапию? В-третьих, каковы оптимальные дозы и точки введения препарата в различные мышцы? В-четвертых, какая комбинация средств медицинской реабилитации и ботулинотерапии оптимальна в различных сроках давности заболевания?
Таким образом, проблема восстановительного лечения постинсультного спастического мышечного гипертонуса с использованием ботулотоксина в течение многих лет занимает одно из важных мест в практической неврологии и нейрореабилитации и требует дальнейшего изучения.
Литература
- Суслина З. С., Танашян М. М., Ионова В. Г. Ишемический инсульт: кровь, сосудистая стенка, антитромботическая терапия. М.: Медкнига, 2005. 248 с.
- Кадыков А. С., Черникова Л. А., Шахпаронова Н. В. Реабилитация неврологических больных. М.: МЕДпресс-информ, 2009. 560 с.
- Штульман Д. Р., Левин О. С. Неврология: справочник практикующего врача. 5-е изд., доп. и перераб. М.: МЕД прессинформ, 2007. 960 с.
- Завалишин И. А., Стойда Н. И., Шитикова И. Е. Клиническая характеристика синдрома верхнего мотонейрона. В кн.: Синдром верхнего мотонейрона. Под ред. И. А. Завалишина, А. И. Осадчих, Я. В. Власова. Самара: Самарское отд. Литфонда, 2005. С. 11–54.
- Кадыков А. С., Шахпаронова Н. В. Сосудистые заболевания головного мозга: справочник. М.: Миклош, 2006. 192 с.
- Белова А. Н., Прокопенко С. В. Нейрореабилитация. 3-е изд., перераб. и доп. М.: Антидор. 2010. 1288 с.
- Артемьев Д. В., Орлова О. Р., Мренькова А. З. Использование ботокса в медицинской практике // Журнал неврологии и психиатрии им. С. С. Корсакова. 2000. № 4. С. 46–51.
- Орлова О. Р. Применение ботокса (токсина ботулизма типа А) в клинической практике: руководство для врачей. Под ред. О. Р. Орловой, Н. Н. Яхно. М.: Каталог, 2001. 208 с.
- Jankovic J. Botulinum toxin in movement disorder // Curr. Opin. in Neurology. 2006. Vol. 7. P. 358–366.
- Дамулин Н. В. Использование ботулинического токсина в неврологической практике // Неврологический журнал. 2000. № 3. С. 39–47.
- Хайман Н. Н. Лечение дистонии и спастичности ботулиническим токсином (краткое руководство для врачей). СПб, 2000. 24 с.
- Boud R., Graham K. Botulinum toxin A in the management of children with cerebral palsy: indications and outcome // Europ. J. of Neurol. 2007. Vol. 4. P. 15–22.
- Kanovsky P., Slawek J., Denes Z. Efficacy and safety of botulinum neurotoxin NT 201 in poststroke upper limb spasticity // Clin. Neuropharm. 2009. Vol. 32. P. 59–65.
- Koman L., Ferrarri E., Mubarak S. Botulinum toxin type A (BTA) in the treatment of lower limb spasticity associated with cerebral palsy // Dev. Med. Child. Neurol. 2005. Vol. 37. P. 19–20.
- Bakheit A. M., Fedorova N. V., Skoromets A. A. The beneficial antispasticity effect of botulinum toxin type A is maintained after repeated treatment cycles // J. Neurol. Neurosurg. Psychiatry. 2004. Vol. 75. P. 1558–1561.
- Davis E., Barnes M. The use of botulinum toxin in spasticiny // In: Upper motor neuron syndrome and spasticity. Cambridge University Press. 2001. P. 206–222.
- Bakheit A. Botulinum toxin treatment of muscle spasticity // AuthorHouse., 2 nd–2007. 216 p.
- Орлова О. Р. Применение ботулотоксина в неврологии и косметологии // Нувель эстетик (Русское издание). 1998. № 7. С. 25–27.
- Autti-Ramo J., Larsen T., Peltonen J. The use of botulinum toxin treatment in children with movement disorders // Europ. J. of Neurol. 2007. Vol. 4. P. 23–26.
- Royal M. The use of botulinum toxin in the management of myofascial pain and other conditions associated with painful muscle spasm. In: Brin M., Jankovic J., Hallet M. eds. Scientific and Therapeutic Aspects of Botulinum Toxin. Philadelphia: Lippincott Williams & Wilkins. 2002. 204 p.
- Хатькова С. Е. Современные подходы к ведению постинсультных больных со спастичностью: значение комплексной терапии с использованием ботулотоксина // Фарматека. 2006. № 7. С. 88–92.
- Simpson D., Gracies J.-M., Graham H. Assessment: Botulinum toxin for the treatment of spasticity (an evidence-based review): Report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology // Neurology. 2008. Vol. 17. Р. 1691–1698.
- Watanabe Y., Bakheit A., McLelan D. A study of the effectivenes of botulinum toxin type A in the management of muscle spasticity // Dis. Rehab. 2008. Vol. 20. P. 62–65.
- Dressler D., Mander G., Fink K. Equivalent potency of Xeomin® and Botox® // Mov. Disord. 2008. Vol. 23. P. 20.
- Graboski C., Gray D., Burnham R. Botulinum toxin a versus bupivacaine trigger point injections for the treatment of myofascial pain syndrome // Pain. 2005. Vol. 118. P. 70–75.
- Хатькова С. Е. Использование ксеомина при лечении постинсультной спастичности // Журнал неврологии и психиатрии им. С. С. Корсакова. 2010. № 8. С. 62–63.
- Corry I., Cosgrove A., Walsh E. Botulinum toxin A in the hemiplegic upper limb: a double-blind trial // Dev. Med. Child. Neurol. 2007. Vol. 9. P. 185–193.
- Моренкова А. Э., Орлова О. Р. Ботокс в лечении болевых синдромов // Лечение нервных болезней. 2001. Т. 2. № 1. С. 28–30.
- Childers M. The use of botulinum toxin type a in pain management. 2 nd ed. Academic Information Systems. 2008. 133 p.
- Davis E., Barnes M. The use of botulinum toxin in spasticiny // In: Upper motor neuron syndrome and spasticity. Cambridge University Press. 2001. P. 206–222.
- O’Brien C. F. Injection techniques for botulinum toxin using electromyography and electrical stimulation // Muscle and Nerve. 1997. Vol. 20. P. 176–180.
- Белоусова Е. Д. Диспорт в лечении эквиноварусной деформации стопы // Неврологический журнал. 2001. Т. 6. № 6. С. 42–44.
- Brin M. The spasticity Study Group. Dosing, administration and a treatment algorithm for use of botulinum toxin A for adult-onset spasticity // Muscle and Nerve. 1997. Vol. 20. P. 208–220.
- Оддерсон И. Ботулинотерапия. Карманный справочник. М.: Практика, 2011. 176 с.
- Орлова О. Р., Артемьев Д. В., Голубев В. Л., Яхно Н. Н. Применение токсина ботулизма в неврологической практике / Сборник трудов «Актуальные военные вопросы клинической и военной неврологии». СПб, 1997. С. 205.
- Albany K. Physical and occupational therapy considerations in adult patients receiving botulinum toxin injections for spasticity // Muscle and Nerve. 2009. Vol. 20. № 6. P. 221–231.
- Kamanli A., Kaya A., Ardicoglu O. Coparison of lidocaine, botulinum toxin injections and dry needling to trigger points in myofascial pain syndrome. Rheumatol Int. 2005. Vol. 25. P. 4–11.
- Relja M. Treatment of tension-type headache by local injection of botulinum toxin // Eur. J. Neurol. 1997. Vol. 4. P. 71–73.
- Satila H., Iisalo T., Pietikainen T. Botulinum toxin treatment of spastic equinus in cerebral palsy // J. Phys. Med. Rehabil. 2005. Vol. 54. P. 55–65.
А. А. Королев, кандидат медицинских наук
ФГБУ «Всероссийский центр экстренной и радиационной медицины им. А. М. Никифорова» МЧС России, Санкт-Петербург


.gif)
_550.gif)